Raplシグナルによる免疫細胞動態の新展開
低分子量G蛋白質Rap1はケモカインや抗原受容体によって活性化されインテグリン接着性を亢進させる働きをしています。Rap1シグナルによってインテグリンを介する細胞接着がどのように調節され、免疫細胞の動態や抗原認識にどのような役割を果たしているのかを明らかにすること、
そしてその成果を免疫疾患の病態解明や治療戦略に応用することを目指しています。これまでRap1−GFP結合蛋白質RAPL、蛋白質キナーゼMst1を同定し、β2インテグリン活性化やリンパ球ホーミングにおける役割を報告しました。さらに、2光子組織イメージングの改良によってリンパ節内組織移動、
胸腺細胞の移動や選択過程、制御性T細胞機能、免疫シナプスにおける役割が明らかになってきました。また一分子イメージングの手法を確立することによってLFA-1/ICAM-1結合動態が初めて計測可能になり、Rap1シグナルによるkindlin-3調整が明らかになりました。
過去のRap1機能に関する業績解説はこちら。2012年以降は以下を参照。
1.末梢リンパ球動態:
リンパ球は末梢リンパ節と血管内を再循環しています。二光子顕微鏡を用いた生体イメージングが開発され、リンパ節内に移動したリンパ球が非常に高速に移動している様子が観察されました。片貝講師(現新潟大学医学部教授)は、リンパ組織が間葉系ストローマ細胞(fibroblastic
reticular cells,FRC)が網目のような組織を構築し、樹状細胞、リンパ球が密接に分布することに着目し、リンパ球動態との関連を二光子顕微鏡を用いて解析しました(図1・Video1)。
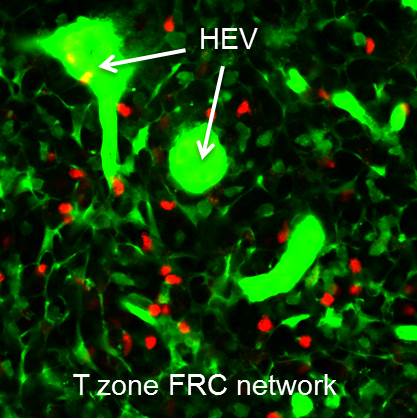 |
図1
二光子顕微鏡によるリンパ組織イメージング
HEV (高内皮細静脈)、濃い緑)、
FRC(ストローマ細胞、緑)、T細胞 (赤) |
(Video1: 二光子組織イメージングによる3D表示FRC(緑)、T細胞(赤))。
↑Internet Explorer 以外のブラウザの方はこちらをクリック。
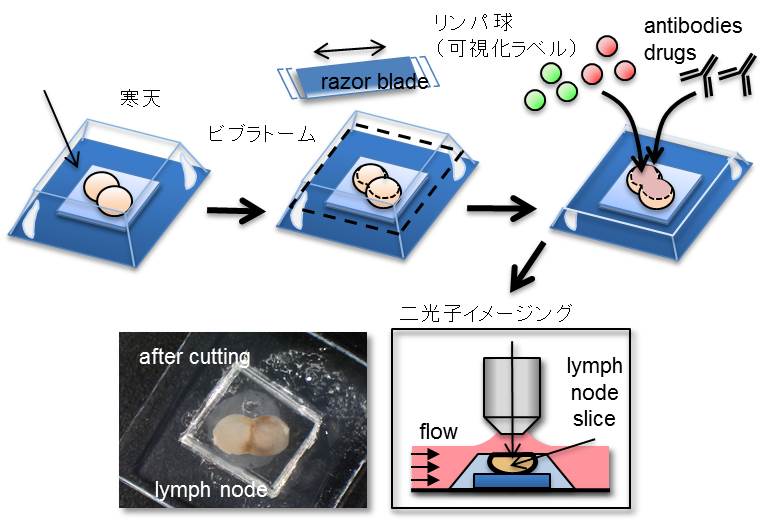
イメージング手法として従来のintravital法、explant法に加え、新たにリンパ節スライスを用いた手法(図2)を比較検討し、3つの手法でほぼ同じT細胞の活発な移動を観察できること、その動態の詳細な解析から高速で直線的に移動する細胞と低速でランダムに移動する細胞に区別されることを見出しました。この動態にLFA-1/ICAM-1やケモカインが関与するか抗体や阻害剤を用いて解析した結果、高速移動にLFA-1/ICAM-1およびGiシグナルが必要であることが判明しました(図3)。
 |
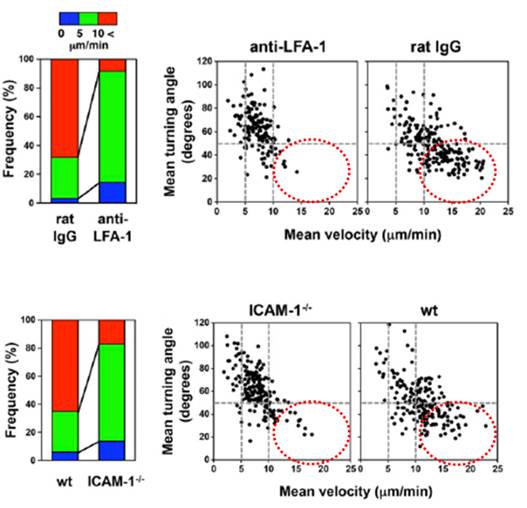 |
図2
リンパ節スライス組織を用いた二光子イメージング
リンパ節を寒天に包埋後、ビブラトームで被膜をカットし、ラベリングされたリンパ球を組織に添加する。酸素で飽和した培地を潅流させながら二光子顕微鏡で観察。この方法で抗体や阻害剤を直接添加でき、効果を評価できる。
|
図3
LFA-1/ICAM-1阻害剤によるリンパ球組織移動移動の低下
上段左 LFA-1抗体添加によって移動速度の低下がおこる。
上段右 移動速度(横軸)と方向変化(縦軸)のグラフ
高速で直線成分を含む移動がLFA-1抗体によって減少
(赤点 線)下段左、右。
I CAM-1欠損マウス由来リンパ節を用いた同様の解析
ICAM-1欠損によっても高速で直線的成分を含む移動
が障害。
|
また、T細胞はストローマ細胞、樹状細胞のどちらのICAM-1に依存しながら移動するのか明らかにするために、ICAM-1をストローマ細胞で欠損させた場合、骨髄由来細胞で欠損させた場合について比較したところ、骨髄系由来の細胞、特に樹状細胞が発現するICAM-1が必要であることが判明しました。実際、T細胞は樹状細胞に接触しながら移動している様子が組織内で観察されました(Video2)。さらに、T細胞の組織内密度を低下させた場合、LFA-1/ICAM-1を介する高速移動が増加することもわかりました。片貝講師はストローマ細胞がCCL21とともにautotaxin(ATX)を発現していることに着目し、ATXが産生するLPAがRhoシグナルを介して低速移動を刺激していることを明らかにしました。
(video 2:樹状細胞(緑)、T細胞(赤))
↑Internet Explorer 以外のブラウザの方はこちらをクリック。
- Katakai T, Kinashi T, Microenvironmental Control of High-Speed Interstitial
T Cell Migration in the Lymph Node. Front Immunol. 2016 May 13;7:194. doi:
10.3389/fimmu.2016.00194. eCollection 2016.
- Katakai T., Kondo N., Ueda Y., and Kinashi T., Autotaxin Produced by Stromal
Cells PromotesLFA-1?Independent and Rho-Dependent Interstitial T Cell Motility. 2014;J
Immunol 2014;193:617-626; Prepublished online 16 June, (doi: 10.4049/jimmunol.1400565)
- Katakai T, Habiro K, Kinashi T. Dendritic Cells Regulate High-Speed Interstitial
T Cell Migration in the Lymph Node via LFA-1/ICAM-1. J Immunol 191(3):1188-99. 2013 DOI: 10.4049/jimmunol.1300739
2.胸腺および自己免疫疾患:
Mst1キナーゼによる胸腺細胞の移動と自己抗原認識の機構
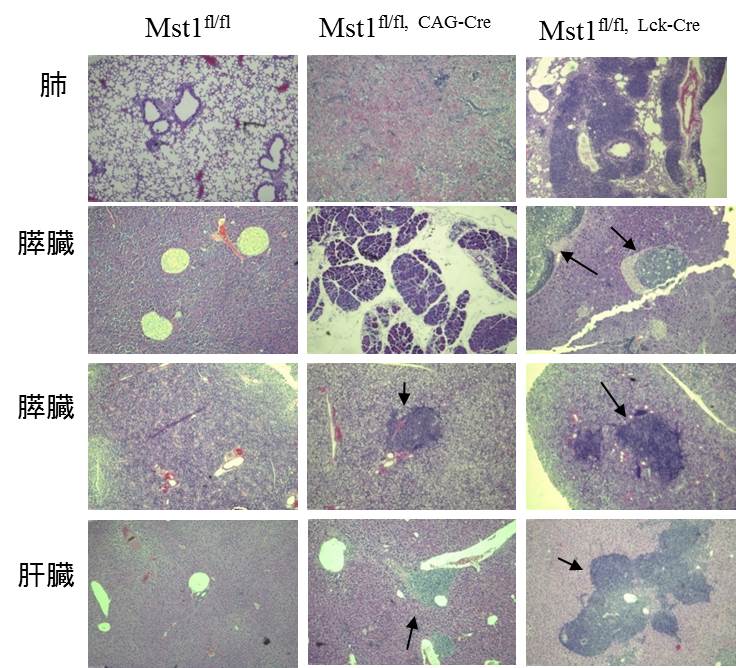
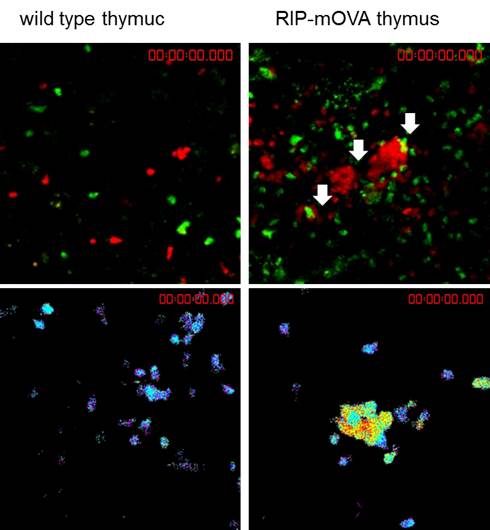
Mst1欠損マウスはリンパ球ホーミング異常や胸腺細胞の移出異常によって末梢リンパ組織が低形成になりますが、加齢とともにリンパ球、白血球の多臓器へ浸潤(図1)、抗DNA抗体などの自己抗体産生が顕著になります。植田講師はその原因がT細胞の自己寛容形成過程の異常にあることを突き止めました。Mst1をT細胞系列で欠損させ、自己免疫病態が起こること、TCRトランスジェニックマウスモデルを用いて胸腺細胞の選択異常があることを明らかにしました。胸腺組織スライスを用いた二光子イメージングによってMst1が胸腺細胞、とくに髄質存在する成熟胸腺細胞の移動に関与していることを見出しました。一般に自己寛容は胸腺内で自己反応性胸腺細胞の除去、いわゆる負の選択が関与すると考えられています。そこでモデル自己抗原としてovalbumin(OVA)をラットのインスリンプロモーターによって発現させたトランスジェニックマウス(RIP-OVA)由来の胸腺組織とOVA特異的TCRを発現するマウス由来T細胞を共培養して負の選択過程を再現し、二光子顕微鏡で観察したところ、OT-II
胸腺細胞が胸腺上皮細胞とクラスターを形成し、その過程でCa2+の濃度が上昇している様子が観察されました(図2)。
 |
 |
| 図1 Mst1欠損マウスに発症する多臓器の炎症像
左列 Mst1 flox マウス(正常)、中央列 Mst1欠損マウス、右列 T細胞系列Mst1欠損マウス
|
図2 胸腺組織イメージング
上段 野生型胸腺組織(左)とRIP-OVA胸腺(右)における
野生型胸腺細胞(緑)、OVA特異的(OT-II)胸腺細胞(赤)のイメージング。
下段 カルシウムイメージング。OT-II胸腺細胞(Indo-PE3ラベル)の野生型胸腺(左)およびRIP-OVA胸腺におけるカルシウム応答。OT-II胸腺細胞はRIP-OVA胸腺内でクラスターを形成し(矢印)、カルシウムの上昇を示す。
|
免疫染色およびAire-GFP knock-inマウスを用いた解析から、Aire(autoimmune regulator)を発現している胸腺上皮細胞にOVA抗原依存的にLFA-1/ICAM-1を介して強く接着していること、Mst1欠損するとその接着過程が障害されることが判明しました(Video3)。この結果はAire陽性胸腺上皮細胞が抗原を提示していること、およびその障害が自己反応性胸腺細胞の除去の低下、自己免疫発症につながったと推察されました。
|

