





 |
 |
 |
 |
 |
 |
 |
�@�q�g�s�זE�����a�E�C���X�P�^ (HTLV-1)���R�[�h����]�ʊ��������qTax�́Ain vitro�ɂ����āA�q�g�s�זE�̕s�����A�����3T3��Rat-1�זE���y�у��b�g��@�ۉ�זE�̃g�����X�t�H�[���[�V������U�����邱�ƁA����ɁA�g�����X�W�F�j�b�N�}�E�X�Ɏ�ᇂ��������邱�ƂȂǂ���A���l�s�זE�����a�iATL�j�̎�v�ȕa�����q�ł���ƍl�����Ă���BTax�ɂ��]�ʐ���́ATax�ƍזE���̓]�ʐ�����q�Ƃ̒��ڂ̑��ݍ�p�ɗR�����邪�A���̂悤�ȍזE���q�Ɋւ��ẮA����܂Ŋ���10��ވȏ�̂��̂�����Ă���A��ᇉ��̋@�\���ꌳ�I�ɐ������邱�Ƃ͓��1)�B
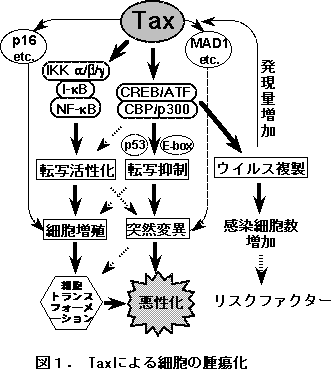
�@�זE��`�q�̊������ɂ����ẮATax��IKK�����̂Ƃ̉����v�ȃ��[�g�Ƃ���NF-kB�̊��������ł��d�v�ł���Ǝv����2)�i�}�P�j�B���ہAHTLV-1�����זE�ɂ�����T�C�g�J�C���Y����\�ʍR���̔������������ł͂Ȃ��A�T�C�N����D2���̍זE����������q�̓]�ʊ�������A�|�g�[�V�X�̗}����NF-kB�������Ő����Â����Ă���B�܂��ATax����������ATL��ᇍזE�ɂ����Ă�NF-kB���P��I�Ɋ���������Ă��邱�Ƃ���ANF-kB�������͎�ᇍזE�̏d�v�Ȍ`���ł���ƍl������3)�B
�@����AHTLV-1�v�����[�^�[�������̉�͂��疾�炩�ƂȂ���Tax�Ɠ]�ʈ��qCREB/ATF����т���co-activator CBP/p300�Ƃ̑��ݍ�p�́A�h���`�q�̔������߂ɂ����ẮA�ނ��딭���}���Ɋ֗^����i�}�P�j�B����܂łɁAc-myc�ɑ�\�����E-box�����`����A����}����`�qp53�̓]�ʈ��q�Ƃ��Ă̋@�\���A���ʂ̕⏕���q�ł���CBP/p300��Tax�Ƌ������邱�Ƃőj�Q����邱�Ƃ�������Ă���4)�B�����]�ʈ��q�̕W�I�ƂȂ�זE��`�q�̂Ȃ��ɂ́A�h��Q�m���̈��萫�𐧌䂵�Ă�����̂������A���ʓI�ɓˑR�ψق��U���E�~�ς����ᇂ̈��������i�ނƍl�����Ă���B
�@��L�ȊO�ɂ��ATax�͑��l�ȍזE���q�Ƒ��ݍ�p���A�����̑������זE�̑��B���䂠�邢�͈�`�q�ˑR�ψقɊ֘A���邱�Ƃ���A�����̈��q�̑����I�ȍ�p���זE�̎�ᇉ��ߒ��Ɋ֗^����Ƒz������Ă���5)�B
�@Tax�̔����͗l�X�ȋ@�\��ʂ��čזE����ᇉ��ɓ������Ƃ���������Ă��邪�AHTLV-1�����̓��ɂ����Ă�Tax���܂߂��E�C���X��`�q�̔����͋����}������Ă���6)�B����ɋ������邱�ƂɁA����犴���זE��in vitro�ɂ����Ĕ|�{����ƁA�����̏ꍇ�A�Z���ԂŃE�C���X��`�q�̔������Ċ����������B���̂��Ƃ́A�̓��ɂ����锭���}������ߓI�Ȃ��̂ł���A�E�C���X�̔����Əh��ɂ�锭���}���@�\�Ƃ̊ԂɁA���炩�̓��I�ȕ��t�W�����݂��邱�Ƃ��������������B���������āA�����ǃE�C���X�����ҁi�E�C���X�L�����A�[�j�ɂ����Ă͂��̗l�ȓ��I���t�̏�Ԃ��ۂ���Ă���A���ꂪATL���ǂɂ����钷�����������K�肵�Ă���ƍl������B
�@�̓��ɂ�����E�C���X�����}���̂ЂƂ̑傫�ȗv���́ATax��W�I�Ƃ���זE��Q���s�זE(CTL)�ł��邱�Ƃ������̌������玦����Ă���7)�B���ہATax ��CTL�G�s�g�[�v�����HLA �n�v���^�C�v�𑽂����ƌn�ł́AATL�̔��Ǘ����L�ӂɒႢ���Ƃ�����Ă���8)�B�܂��AHTLV-1�����ɂ��g�����X�t�H�[���������b�g�s�זE��p����������������ATax�ɑ���CTL�����������s�זE�̏����Ɏ�v�Ȗ������ʂ������Ƃ��ؖ�����Ă���9)�B
�@�������Ȃ���ACTL�����݂̂ōזE���x���ł̃E�C���X�����̗}����������邱�Ƃ͓�����Ƃ���A��X�̓E�C���X��`�q�̈�ߓI�}�����Č����铮�����f���n�̊m�������݂�10)�B
�@�@�����ŁATax�ɂ��]�ʊ��������Č����邽�߁AMLV LTR U3�̈��HTLV-1�̂��̂Ɠ���ւ��A�܂��A�זE���x���ł̈�`�q������ǐՂł���悤�ɁATax�ƌu���`��GFP�Ƃ̗Z���`��(Gax)������悤�ɍ\�z�����g�������g���E�C���X���쐬���A������v���E�C���X�Ƃ��đg�ݍ��}�E�X�s�����p��זE��EL-4 (EL-4/Gax)�̃}�E�X�̓��ł̓��Ԃ���ш�`�q��������͂����i�}�Q-�@�j�B
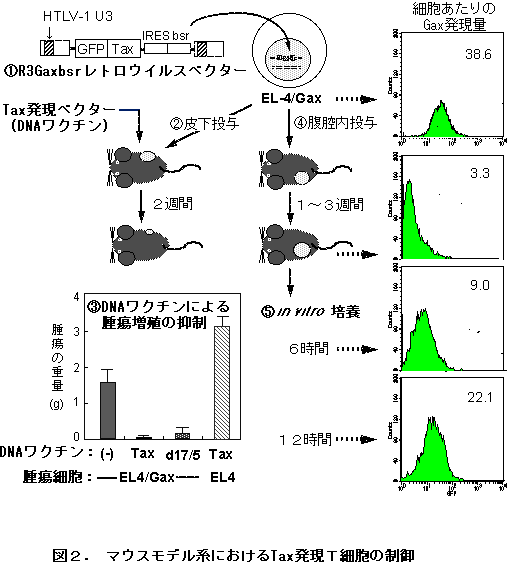
�@�܂��A���̌n�ɂ����čRTaxCTL����ᇂ̑��B�𐧌䂵���邩�ǂ����m�F���邽�߁ATax�����v���X�~�hDNA�̃}�E�X�ؓ����ւ̒��ړ��^�ɂ��A�RTaxDNA���N�`���̌��ʂ����������B���̌��ʁATax�쐶�����邢�͋@�\�����ψّ�(D17/5)����̔����v���X�~�h�̓��^�ɂ����Ă��A�RTaxCTL�̗U�����Ƃ��Ȃ��ATax����EL-4�זE�̎�ᇑ��B�̗}�����ώ@���ꂽ�i�}�Q-�A�A�B�j�B
�@�RTaxDNA���N�`�����^�ɂ��A�牺�ɂ����đ��B�}������Tax����EL-4�זE�́A���̑傫����ۂ����܂܌̓��Ɉێ�����Ă������߁A����ᇓ��ɂɂ�����Tax�̔����ׂ��Ƃ���A���̔����͋����}������Ă����B
�@�����ŁA��ᇍזE�o���ɓ��^���זE���x���ł̈�`�q�������o���I�ɒǐՂ����Ƃ���A���^��A��1�T�Ԃ�Tax��`�q�̔������}������邱�Ƃ��m�F���ꂽ�i�}�Q-�C�j�B�Ƃ��낪�A���̗}����Tax�ɑ���Ɖu��N�̗L���Ɉ˂炸�ώ@����ACTL���l���Ɖu�Ƃ͓Ɨ��ɋN���邱�Ƃ����炩�ƂȂ����B
�@���ɁA�}�E�X���o����Tax��`�q����EL-4�זE�ɂ����ė}������Tax�̔������Ain vitro�̔|�{�ōĊ���������邩�ǂ������������B���̌��ʁA�|�{��A�����Ԃ�GFP�̌u�����x�̑������ώ@����A�}�E�X���o���ɂ����Ă������̂Ɠ��l�ȃE�C���X��`�q�����̈�ߓI�ȗ}�����N�����Ă��邱�Ƃ������ꂽ�i�}�Q-�D�j�B
�@��ʂɃ��g���E�C���X�x�N�^�[��p���ē������ꂽ��`�q�̔����́A�����̏ꍇ�A�̓��ɂ����ė}������邱�Ƃ��m���Ă���A���ꂪ��`�q���ÂɃ��g���x�N�^�[���g�p����ۂ̑傫�Ȗ��_�ƂȂ��Ă���B���ہAMLV�x�N�^�[��EL-4�ɓ�������EGFP�̔����́A���o���ŗ}��������Ain vitro�|�{�ɂ����Ă��Z���Ԃł͉��Ȃ����Ƃ���A�̓��ł̃E�C���X�����̈�ߓI�ȗ}���@�\�́AHTLV-1�̓]�ʒ��߂ɓ��L�Ȍ��ۂł���\��������A�����̓��ɂ�����HTLV-1�̃��C�t�T�C�N�����l�����ŏd�v�ȈӖ������Ǝv����B
�@�ȏ�ɏq�ׂ��悤�ɁA�זE��ᇉ��̌����ƍl������Tax�`���́A���ۂɂ́A�ʏ�A�̓��ł̔������}������Ă���A���炩�̗v���ň�ߓI�ȗ}�����������ꂽ�ꍇ���ACTL�̕W�I�ƂȂ蔭���זE�͑��₩�ɔr�������ƍl������B�����̂ɂ����Ă͂��̃T�C�N�����J��Ԃ���A���̊ԂɈ�ߓI�ɔ�������Tax�̍זE�ւ̍�p�̐ςݏd�˂̌��ʁA��ᇍזE���o������Ƒz�������i�}�R�j�B�܂��A�������̉ߒ��ɂ����āA��ᇍזE��Tax�@�\���ւ����`�q�ψق��l�����邱�ƂŁA�RTaxCTL����Ƃꂽ�������ł̑��B���\�ƂȂ�B���ہA�}���]������ATL��ᇍזE�̑����́A�v���E�C���X��5�-LTR��������Tax���ł��Ȃ��Ȃ��Ă���B
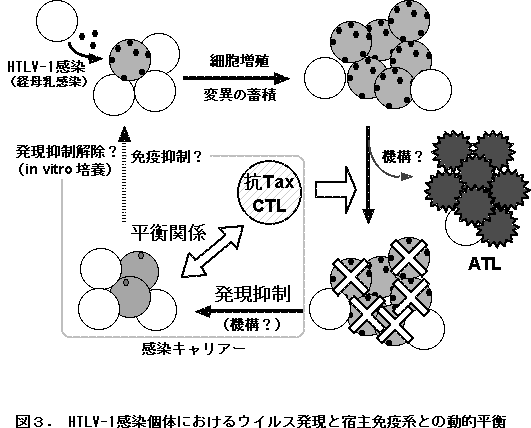
�@���������āA�E�C���X�����זE�̐��i=�v���E�C���X���[�h�j�͊m���_�I�ȕꐔ�̑������Ӗ����AATL���ǂ̃��X�N�t�@�N�^�[�ƍl������̂ɂ������A�RTaxCTL��������ь̓��ɂ�����E�C���X�����̈�ߓI�}���@�\�͂Ƃ��ɁA���ǐ�����q�Ƃ��ĂƂ炦�邱�Ƃ��o����B�{�M�ɂ�����P�O�O���l�߂�HTLV-1�����҂��A���U���Ǘ����̊m����ATL�ǂ��邱�Ƃ��l�����킹��ƁA���X�N�t�@�N�^�[�̌y����ATL���Ǘ\�h�ɂ����Ď�v�ȉۑ�ł��邱�Ƃ͊ԈႢ�Ȃ��BTax DNA���N�`����Tax�y�v�`�h���N�`���ɂ��RTaxCTL�̑��������ǂ̃��X�N�����������邱�Ƃ��o����̂��ǂ����A���邢�͌̓��ɂ�����E�C���X�����}���@�\�͂ǂ̂悤�Ȃ��̂��A�����̉�͂�ATL���Ǘ\�h�ɂނ������g�݂Ƃ��Č����K�v�ł���A���̂��߂ɂ́A�}�E�X��b�g��p�����������f���́A�L�p�ȏ��������ƍl����B
�@����A�ЂƂ���ATL�ǂ����ꍇ�A��ᇍזE�͒Z���Ԃŗl�X�ȉ��w�Ö@�܂ɑ���ϐ����l�����邱�Ƃ���A�����L���Ȏ��Ãv���g�R�[���͊m�����Ă��Ȃ��B�������Ȃ���A�ߔN�AATL���Âɂ����č�����j��I���햖���������ڐA�i�~�j�ڐA�j�����ʓI�ł���Ƃ�������\����Ă���B������ɂ����ẮA�ڐA���HTLV-1�v���E�C���X���������A�܂��A�h�i�[�R���̍RTaxCTL�̑���������Ă��邱�Ƃ���A�E�C���X�R����W�I�Ƃ����R��ᇌ��ʂ̑��݂�������������A����A�E�C���X��������Ɠ��������������ł̎��Ẩ\�������҂����B