研究内容




研究内容



HTLV-1に感染した人の一部しかATLやHAMを発症しません。これには感染者体内の宿主免疫とウイルス感染細胞の動態のバランスが重要な役割を果たしていると考えられています。この関係を明らかにし、これをATL発症予防ワクチンの開発・評価に応用する目的で、重度免疫不全マウス(NOG-SCID:NOD-SCID/IL-2 receptorγchain knock-out) の骨髄内にヒト臍帯血由来造血幹細胞を移植しヒト造血細胞系を再構築したマウス(ヒト化マウス、hu-NOG)を作製したうえ、この腹腔内にHTLV-1感染細胞を移入することで、マウス個体内のヒトT細胞にHTLV-1を感染させることに成功しました。
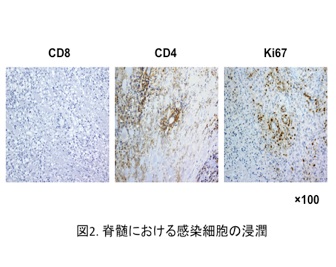
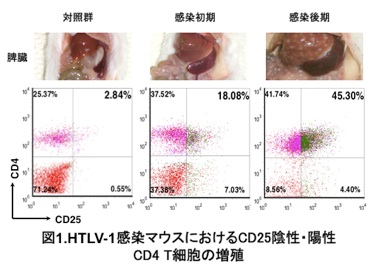
このHTLV-1感染ヒト化マウスは、感染数ヶ月で脾腫をきたし、ATLと同様にHTLV-1感染CD4陽性T細胞の異常増殖が観察されました(図1)。また、骨髄移植後早い時期にHTLV-1を感染させた場合、約1ヶ月後に歩行困難を示すマウスが出現したため、剖検したところ、HAMで見られるのと同様に、脊髄内にHTLV-1感染細胞の浸潤が観察されました(図2)。従って、HTLV-1感染ヒト化マウスにおいて、それぞれ全く異なった2種類のHTLV-1関連疾患の病態が再現されたことになります。今後、感染の時期や移入感染細胞の量等を検討することで、これら異なった病態の発生要因を明らかにしていきたいと考えています。

これまで、HTLV-1はマウスに感染しないと考えられてきましたが、マウス腹腔にHTLV-1感染ヒトT細胞株を移入することで、マウスのTリンパ球にHTLV-1を感染させることに成功しました。そこで、同感染マウスを用いて、感染T細胞の経時的な増加や表面マーカーの変化を追跡することで、長い潜伏期間におけるATL発症過程を解析しています。
これまでに、個体内においては樹状細胞にもHTLV-1が感染しており、感染のリザーバーとなる可能性が示唆されています。また、感染初期において検出された複数の感染クローンが、次第に限られたクローン数の、ATL細胞と同じ制御性T細胞様表面抗原[CD4(+)CD25(+)]を有するT細胞に収束する様子も観察され、感染細胞の癌化過程を再現するものとして注目しています。

ATLの原因であるHTLV-1の発現は感染者体内では抑制されており、これがATL発症における長い潜伏期間の原因と考えられています。そこで、どのような機構でこの抑制が外れてT細胞が癌化に導かれるのかを明らかにするため、HTLV-1遺伝子を発現するように改変したマウスリンパ腫細胞のマウス移植系を用いて、個体内特異的な遺伝子発現抑制機構を解析しています。この実験系を用いてこれまでに、転写制御における転写補助因子TORC2の関与、および抗Tax DNAワクチン投与による腫瘍増殖抑制効果を明らかにしてきました。現在、個体レベルで遺伝子発現が経時的に解析できる”in vivoイメージング”の手技を用いて、個体内におけるウイルス感染細胞の動態解析を進めています。

近年、非骨髄破壊的同種骨髄移植を用いたATL治療において抗Tax CTLの再構築を伴う寛解例が報告されています。その際、GVHDの制御が大きな課題となっていることから、本学、病理学第1講座のグループによって開発された骨髄内骨髄移植とリンパ球輸注の組み合わせによる、GVHDを伴わない抗がん治療法の応用を、上記、マウスリンパ腫細胞のマウス移植系を用いて検討しています。
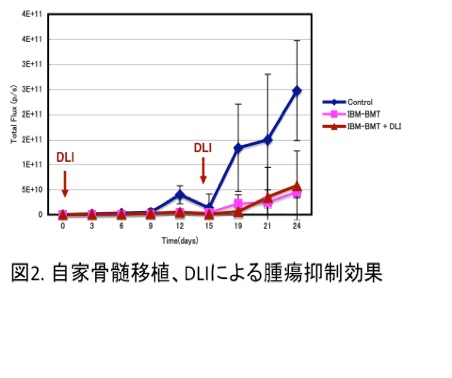
そのために、HTLV-1遺伝子発現マウスリンパ腫細胞にルシフェラーゼ遺伝子を導入し、ルシフェラーゼの発光活性を指標に、in vivoイメージング装置を用いて体内での腫瘍増殖を経時的に計測する系を確立しました(図1)。この系を用い、これまでに、自家骨髄移植とCD4(−)リンパ球細胞の移入(リンパ球輸注/DLI)により、HTLV-1遺伝子発現リンパ腫細胞の腫瘍増殖を抑制することができています(図2)。現在、ヒトにおける骨髄移植治療を視野に入れ、他家骨髄移植とリンパ球輸注の組み合わせ効果を検討中です。