MAPK経路とは
MAP kinase(mitogen-activated protein kinase、以下MAPK)は、酵母から植物・高等動物に至るまで広く真核生物に保存されたセリン/スレオニンキナーゼであり、活性化にともなって核内へと移行することから、細胞外のシグナルを核内へと伝える鍵分子として機能しているものと考えられている(図1参照)。
ほ乳類においては、古典的MAPKとも呼ばれるERK1・ERK2サブファミリー、ストレス活性化キナーゼ(stress-activated protein kinase, SAPK)と総称されることもあるJNK1・JNK2・JNK3サブファミリーならびにp38α・p38β・p38γ・p38δサブファミリー、さらに最近になって急速に解析の進んでいるERK5サブファミリーの、4つの主要なMAPKサブファミリーの存在が知られている。
なお、ERK5はC末端側に転写活性化領域を併せ持つ特異な構造を有しており、他のファミリー分子に比べて分子量が大きくなっていることからBig MAPK (BMK)の別名を持つ。
MAPKの活性化には、キナーゼサブドメインVIIとVIIIの間に存在する活性化ループのスレオニンとチロシンの両方の残基のリン酸化が必須であるが、その配列は各々のサブファミリーによって微妙に異なっている。
すなわち、スレオニン-グルタミン酸-チロシン(一文字アミノ酸コードでTEY、以下同様)の配列がリン酸化を受けるERK1/2ならびにERK5に対し、JNKサブファミリーはスレオニン-プロリン-チロシン(TPY)が、またp38サブファミリーはスレオニン-グリシン-チロシン(TGY)がそれぞれリン酸化を受ける。
この活性化ループのリン酸化とMAPKの活性化とが一対一に対応する事から、現在では、各々の配列に特異的なリン酸化抗体を利用してMAPKの活性化状態を評価することが一般的となっている。
MAPKの活性化ループのリン酸化を担うのは、セリン/スレオニン/チロシンキナーゼに属するMAPKKであり、ERK1/2の活性化にはMEK1・MEK2が、JNKサブファミリーにはMKK4・MKK7、p38サブファミリーにはMKK3・MKK6、ERK5サブファミリーの活性化にはMEK5が各々関与している。
一方、MAPKKの活性化にはMAPKK-Kと呼ばれるセリン/スレオニンキナーゼが関与しており、これらMAPKK-K→MAPKK→MAPKからなるシグナル伝達モジュールは、特にMAPKカスケードと呼ばれている。
MAPKK-Kとしては、ERK1/2の活性化に関与する癌原遺伝子c-Raf-1や、JNK・p38の活性化に関与するTAK1やASK1が知られているが、細胞外シグナルに応じてMAPKK-Kの使い分けがなされるなど、その全貌は未だ明らかになっていない(図2参照)。
癌原遺伝子であるc-Raf-1の下流に位置することから想像されるように、古典的MAPKカスケードの持続的な活性化は細胞のがん化へと繋がる。他のMAPKファミリーについても同様であり、細胞には何重にもわたってMAPKファミリーの不活性化機構が備えられている。
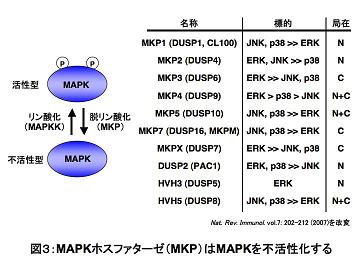
中でも中心的な役割を担っているのは、MAPKホスファターゼ(MAPK phosphatase、MKP)と呼ばれる一連の分子であり(図3参照)、活性化ループのスレオニンとチロシンの両残基からの脱リン酸化反応を媒介する。
興味深いことに、MKPの多くはMAPK自身により発現制御や活性制御を受けており、MAPK経路の負のフィードバック制御に関与するものと考えられている。